
REAKCJE CHEMICZNE 

|
REAKCJE CHEMICZNE |
REAKCJĄ CHEMICZNĄ nazywamy przemianę, w wyniku której z substratów powstają produkty,
czyli substancje o innych właściwościach fizycznych i chemicznych.
RÓWNANIE REAKCJI CHEMICZNEJ to skrócony, symboliczny zapis przemian zachodzących podczas reakcji chemicznej, zgodny z prawem zachowania masy.
SUBSTRATY - substancje użyte do reakcji.
PRODUKTY - substancje otrzymane w wyniku reakcji.
REAGENTY - substancje biorące udział w reakcji, substraty i produkty.
WSPÓŁCZYNNIKI STECHIOMETRYCZNE - liczby poprzedzajace symbol lub wzór w równaniu reakcji. które określają liczbę atomów lub cząsteczek reagentów, np.:
4 Na + O2 --> 2 Na2O
4 atomy sodu reagują z jedną dwuatomową cząsteczką tlenu, tworząc 2 cząsteczki tlenku sodu.
TYPY REAKCJI CHEMICZNYCH
SYNTEZY - z dwóch lub więcej substratów powstaje jeden produkt:
A + B --> AB
np.: węgiel + tlen --> tlenek węgla (IV)
C + O2 --> CO2
ANALIZY - jeden substrat rozkłada się na dwa lub więcej produktów:
AB --> A + B
np.: 2 HgO --> 2 Hg + O2
WYMIANY - z dwóch lub więcej substratów, powstają dwa lub więcej produkty
wymiana prosta (pojedyncza) A + BC --> AB + C
np.: CO2 + 2 Mg --> C + 2 MgO
wymiana złożona (podwójna) AB + CD --> AC + BD
np.: BaS + Ag2SO4 --> Ag2S + BaSO4
Reakcja zobojętniania - reakcja między kwasem i zasadą, w wyniku której kationy wodorowe H+ łączą się z anionami wodorotlenkowymi OH -, np.:
H2SO4 + 2 Na OH --> Na2SO4 + 2 H2O
2 H+ + 2 OH - --> 2 H2O
Reakcja strąceniowa - reakcja, w której następuje wytrącanie osadu substancji trudnorozpuszczalnej, np.:
rekacja kwasu i soli:
HCl + Ag NO3 --> Ag Cl(osad) + HNO3
reakcja zasady i soli:
2NaOH + CuSO4 --> Na2SO4 + Cu(OH)2(osad)
reakcja dwóch soli:
CaCl2 + Na2CO3 --> CaCO3 (osad) + 2 NaCl
Reakcja utleniania i redukcji - reakcje redox
Cu O + H2 --> Cu + H2O
UTLENIANIE - przyłączanie tlenu do pierwiastka lub związku chemicznego (w reakcji wodór przyłączył tlen, dając wodę - utlenił się).
Można również powiedzieć: wodór oddał elektrony czyli zwiększył stopień utlenienia:
H20 --> 2 H+ + 2e
REDUKCJA - proces odłączania tlenu od pierwiastka lub związku chemicznego (w reakcji, tlen odłączył się od miedzi, czyli miedź uległa redukcji)
inaczej: miedź przyłączyła eletrony, zmniejszyła swój stopień utlenienia:
Cu2++ 2e --> Cu0
UTLENIACZ - pierwiastek (zwiazek chemiczny), który oddaje tlen, inaczej: przyłącza elektrony, zmniejsza swój stopień utlenienia.
REDUKTOR - pierwiastek (zwiazek chemiczny), który przyłącza tlen, inaczej: oddaje elektrony, zwiększa swój stopień utlenienia.
W naszej reakcji utleniaczem jest miedź, reduktorem wodór.
Do substancji ulegających redukcji czyli utleniaczy należą:
pierwiastki najbardziej elektroujemne (np. F2, Cl2, Br2, J2)
jony metali na wyższym stopniu utlenienia, jony metali szlachetnych i jon wodorowy (np. Fe3+, Cu2+, Ag+, H+)
związki chemiczne, w których pewne pierwiastki występują na najwyższych stopniach utlenienia (np.:
manganian (VII) potasu KMnO4, w zależności od środowiska, może ulegać redukcji do różnych stopni utlenienia - reakcje przebiegają ze zmainą zabarwienia.
Do substancji ulegających utlenieniu, czyli reduktorów należą:
pierwiastki najbardziej elektrododatnie (np. Na, K, Mg, Ca, Al)
niemetale (np. C, N, S, H)
jony metali i niemetali na niższym stopniu utlenienia (np. Fe2+, Cu +, S2-)
jony ujemne fluorowców, dla których rosną zdolności redukcyjne wraz ze wzrostem mas atomowych (np. Cl -, Br -, J-)
Reakcja egzenergetyczna to reakcja, której towarzyszy wydzielanie się energii, np.: w postaci ciepła - reakcja egzotermiczna.
Reakcja endoenergetyczna to reakcja, która zachodzi dopiero po dostarczeniu energii z zewnątrz, np.: w postaci ciepła - reakcja endotermiczna.
TYPY REAKCJI CHEMICZNYCH W ZWIĄZKACH ORGANICZNYCH
REAKCJA SUBSTYTUCJI (PODSTAWIANIA) - zachodzi wtedy, gdy w cząsteczce reagenta jeden atom lub grupa funkcyjna zostanie zastąpiona przez inny atom lub grupę funkcyjną, np.:
reakcja chlorowania alkanów - podstawienie atomu wodoru atomem chloru:
CH4 + Cl2 --> CH3 Cl + HCl
REAKCJA ADDYCJI (PRZYŁĄCZANIA) - przyłączenie do atomów węgla połączonych wiązaniem wielokrotnym, związku chemicznego. Następuje rozerwanie wiązania wielokrotnego, np.:
przyłączanie chloru do cząsteczki etenu:
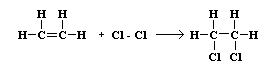
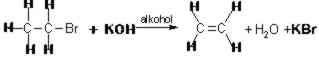
REAKCJA ELIMINACJI - następuje, gdy odczynnik spowoduje oderwanie się prostej cząsteczki od reagenta.
W reakcjach tych powstają wiązania wielokrotne między atomami węgla, np.:
Reakcje spalania zwiazków organicznych
W zależności od dostępu powietrza mogą powstawać różne produkty:
całkowite spalanie - powstaje CO2 i H2O, np.:
CH4 + 2 O2 --> CO2 + H2O
półspalanie - powstaje CO i H2O, np.:
2 CH4 + 3 O2 --> 2 CO + 4 H2O
niecałkowite spalanie - powstaje C i H2O, np.:
CH4 + O2 --> C + 2 H2O
Reakcja polimeryzacji - łaczenie się wielkiej liczby cząsteczek tego samego związku nienansyconego - monomer,
w makrocząsteczki - polimery. Następuje rozerwanie wiązania wielokrotnego w cząsteczkach monomerów, np.:
|
REAKCJE CHARAKTERYSTYCZNE DLA ZWIAZKÓW ORGANICZNYCH
Reakcje charakterystyczne pozwalają na identyfikację substancji.
Reakcja związków nienasyconych z wodą bromową lub roztworem manganianu (VII) potasu KMnO4 - roztwory odbarwiają się.
Reakcja zmydlania
![]() doświadczenie:
doświadczenie:
w parowniczce umieszczamy kawałek tłuszczu (np.: odrobinę smalecu), dodajemy ok. 1 ml etanolu i całość mieszamy. Do próbki dodajemy ok. 1 ml 30% roztworu NaOH i ogrzewamy, co jakiś czas mieszając. Na powierzchni mieszaniny tworzy się piana - powstaje mydło i gliceryna.
Próba akroleinowa - wykrywanie tłuszczów - podczas ogrzewania tłuszczów wydziela się akroleina o charakterystycznym drażniącym zapachu.
Reakcja ksantoproteinowa - wykrywanie białek - pod wpływem kwasu azotowego (V) białko ścina się i żółknie.
Reakcja biuretowa - wykrywanie białek - w obecności wodorotlenku miedzi (II) Cu(OH)2 białko zmienia zabarwienie na ciemnofioletowe.
Reakcja Trommera - wykrywanie aldehydów - reakcja wodorotlenku miedzi (II) z aldehydem mrówkowym (formalina):
pod wpływem redukujących właściwości aldehydu niebieski osad Cu(OH)2 przechodzi w tlenek miedzi (I) Cu2O
i zmienia się zabarwienie próbki na ceglastoczerwone.
Odczynnik Trommera: sprządzamy w probówce z ok. 5 ml rozcieńczonego roztworu siarczanu(VI) miedzi (II) CuSO4
i 1 ml 10% zasady sodowej Na OH - wytrąca się koloidalny osad Cu (OH)2.
![]() doświadczenie: do przygotowanego odczynnika Trommera dodajemy 1 ml formaliny i próbkę ogrzewamy.
doświadczenie: do przygotowanego odczynnika Trommera dodajemy 1 ml formaliny i próbkę ogrzewamy.
Osad w probówce zmienia zabarwienie.
Zachodzi reakcja redox:
HCHO + 2 Cu(OH)2 --> HCOOH + Cu2O + 2 H2O
Próba Tollensa - powstawanie lustra srebrowego - reakcja służąca do wykrywania aldehydów.
Odczynnik Tollensa: do dokładnie umytej probówki wlewamy ok. 5 ml 1% roztworu azotanu (V) srebra - Ag NO3.
Ciągle mieszając, dodajemy kroplami ok. 15% wodny roztwór amoniaku, aż do rozpuszczenia wytrącającego się początkowo osadu.
![]() doświadczenie:
doświadczenie:
do przygotowanego odczynnika Tollensa dodajemy ok. 1 ml formaliny i umieszczamy próbkę w zlewce z gorącą wodą.
Próbki nie ogrzewamy bezpośrednio w płomienu, ponieważ powstanie czarny osad srebra.
Ogrzewamy ją w łaźni wodnej - na ściankach probówki powstanie cienka, błyszcząca warstwa metalicznego srebra - "lustro srebrowe".
Roztworu tego nie wolno przechowywać, ze względu na powstawanie tzw. srebra piorunującego o właściwościach wybuchowych.
Aldehyd mrówkowy ma silne właściwości redukujące:
H CHO + Ag2O --> HCOOH + 2 Ag
Ketony z odczynnikiem Trommera i odczynnikiem Tollensa dają negatywne wyniki próby. Oba odczynniki można wykorzystać do wykrywania glukozy i fruktozy.
Wykrywanie skrobii - próba z jodyną - powstaje charakterystyczne ciemnoniebieskie zabarwienie.